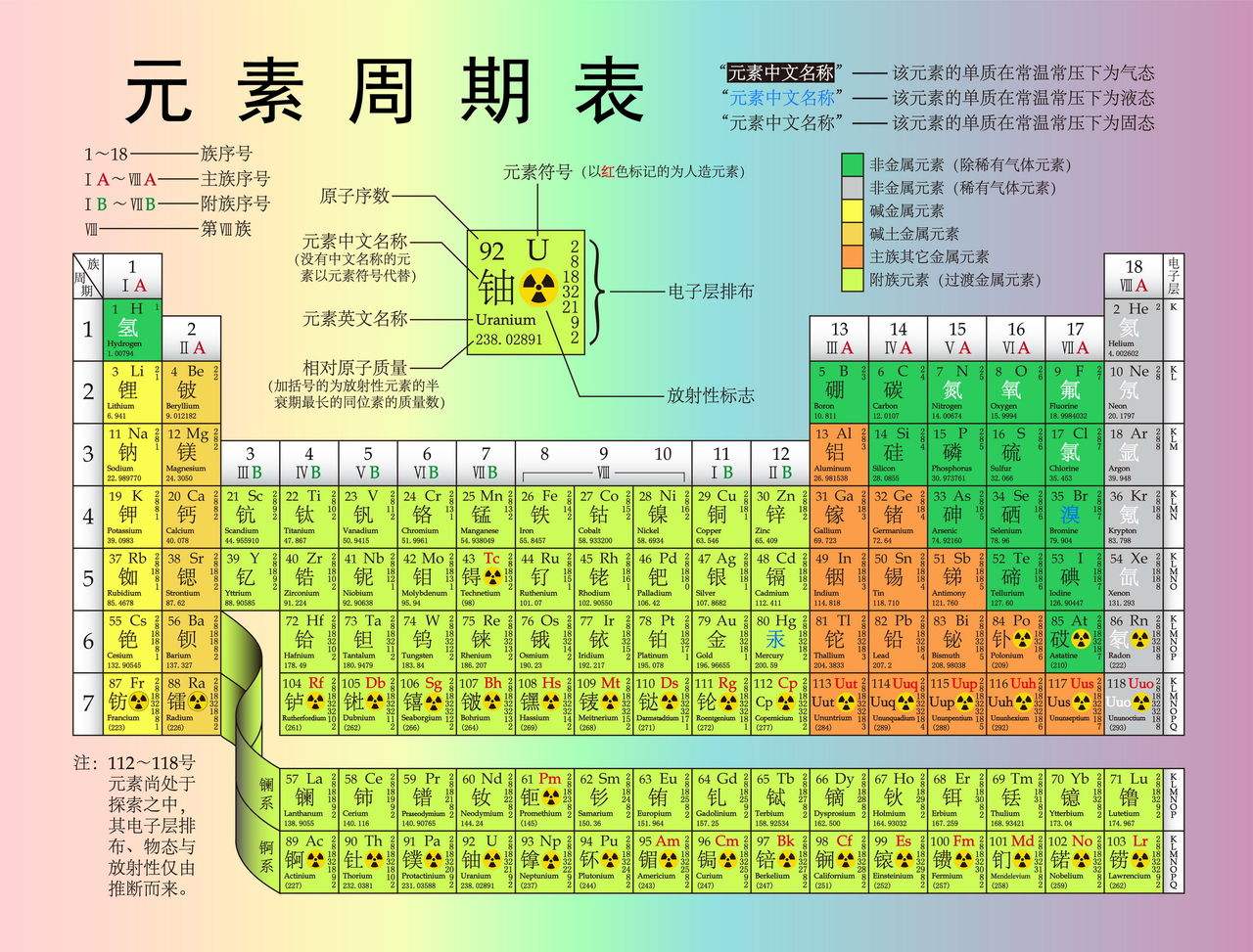
化学元素周期表(Periodic table of elements)是根据元素原子核电荷数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体,非金属,过渡元素等。这使周期表中形成元素分区且分有七主族、七副族、Ⅷ族、18族。由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
俄国化学家德米特里·伊万诺维奇·门捷列夫(Dmitri Mendeleev)于1869年总结发表此周期表(第一代元素周期表),此后不断有人提出各种类型周期表不下170余种,归纳起来主要有:短式表(以门捷列夫为代表)、长式表(以维尔纳式为代表)、特长表(以波尔塔式为代表);平面螺线表和圆形表(以达姆开夫式为代表);立体周期表(以莱西的圆锥柱立体表为代表)等众多类型表。
内容
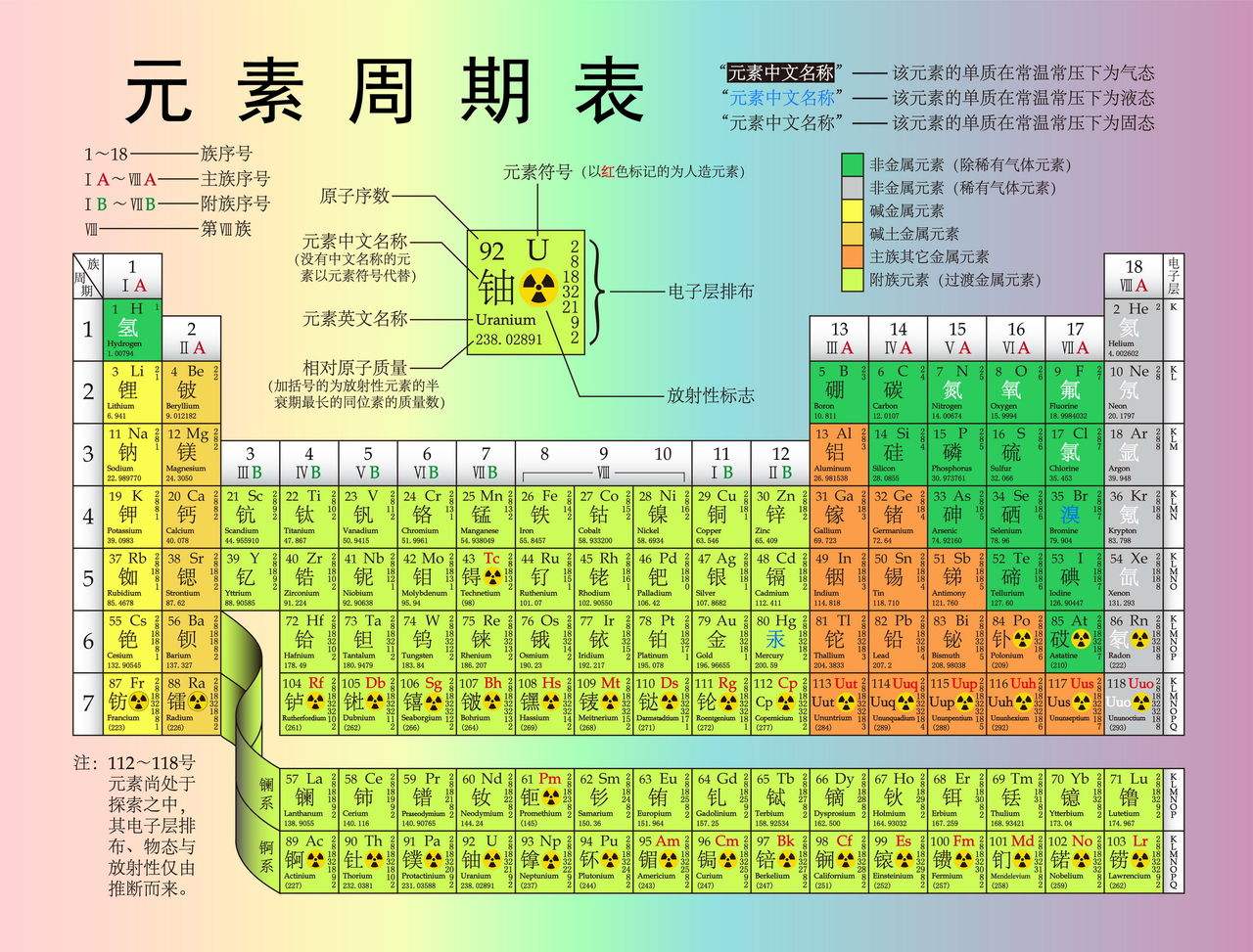
元素周期表
ⅠA族(碱金属)
$$\begin{aligned}&\text { 碱金属物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 碱金属单质 }} & {\text { 颜色和状态 }} & \text { 密度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^3\right) &\text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \left.{ }^{\circ} \mathrm{C}\right) \\\hline \text { 氢 }(\text { 不属于碱金属) } & \text { 无色,气体 } & 0.0000899 & -259.125 & -252.882 \\\hline \text { 锂 } & \text { 银白色,柔软 } & 0.534 & 180.5 & 1347 \\\hline \text { 钠 } & \text { 银白色,柔软 } & 0.97 & 97.81 & 882.9 \\\hline \text { 钾 } & \text { 银白色,柔软 } & 0.86 & 63.65 & 774 \\\hline \text { 铷 } & \text { 银金色,柔软 } & 1.532 & 38.89 & 688 \\\hline \text { 铯 } & \text { 金色,柔软 } & 1.879 & 28.40 & 678.4 \\\hline \text { 钫 } & \text { 红色,柔软 } & 1.87 & 27 & \\\hline\end{array}\end{aligned}$$
1. 还原性; Li
2.氧化性: $\mathrm{Li}>\mathrm{Na}>\mathrm{K}>\mathrm{Rb}>\mathrm{Cs}$
3.碱金属元素能与水或氧气反应生成碱或碱性氧化物
4.氢本来不是碱金属,但因为在IA族,所以归入此表
ⅡA族(碱土金属)
$$\begin{aligned}&\text { 碱土金属物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 碱土金属单质 }} & \text { 颜色和状态 } & \text { 密度 }\left(\times 10^{\mathbf{s}} \mathrm{kg} / \mathrm{m}^{\mathbf{3}}\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathrm{C}\right) \\\hline \text { 铍 } & \text { 钢灰色,较硬 } & 1.848 & 1278 & 2970(\text { (加压) } \\\hline \text { 镁 } & \text { 银白色,柔软 } & 1.738 & 648.9 & 1090 \\\hline \text { 锚 } & \text { 银白色,柔软 } & 1.550 & 839 & 1484 \\\hline \text { 锶 } & \text { 银白色,柔软 } & 2.540 & 769(\text { 加压) } & 1384 \\\hline \text { 钡 } & \text { 银白色,柔软 } & 3.594 & 729 & 1870 \\\hline \text { 镭 } & \text { 银白色,柔软 } & 5 & 700 & 1737 \\\hline\end{array}\end{aligned}$$
ⅢB族(不含镧系和锕系)
$$\begin{aligned}&\text { IIIB族 (不含镧系和锕系) 物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline \text { IIIB族元素单质 } & {\text { 颜色 }} & \text { 密度 }\left(\times \mathbf{1 0} \mathbf{k g} / \mathrm{m}^{\mathbf{3}}\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathrm{C}\right) \\\hline \text { 钪 } & \text { 银白色 } & 2.985 & 1541 & 2830 \\\hline \text { 钇 } & \text { 灰色 } & 4.4689 & 1522 & 3338 \\\hline\end{array}\end{aligned}$$
ⅣB族
$$\begin{aligned}&\text { IVB族物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & \text { 颜色 } & \text { 密度 }\left(\times \mathbf{1 0} \mathbf{k g} /\mathrm{m}^{\mathbf{3}}\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathbf{C}\right) \\\hline \text { 钛 } & \text { 银白色 } & 4.5 & 1660 & 3287 \\\hline \text { 锆 } & & \text { 银白色 } & 6.5 & 1852 & 4377 \\\hline \text { 铪 } & \text { 银白色 } & 13.3 & 2227 & 4602 \\\hline\end{array}\end{aligned}$$
ⅤB族
$$\begin{aligned}&\text { VB族物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & \text { 颜色 } & \text { 密度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^{\mathbf{3}}\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathrm{C}\right) \\\hline \text { 钒 } & \text { 银白色 } & 6.1 & 1902 & 3380 \\\hline \text { 铌 } & \text { 银白色 } & 8.6 & 2468 & 4742 \\\hline \text { 钽 } & \text { 银白色 } & 16.6 & 2996 & 5425 \\\hline\end{array}\end{aligned}$$
ⅥB族
$$\begin{aligned}&\text { VIB族物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & {\text { 颜色 }} & \text { 密度 }\left(\times \mathbf{1 0 ^ { 3 }} \mathbf{k g} / \mathrm{m}^{\mathbf{3}}\right) & \text { 熔点 }\left({ }^{\circ} \mathbf{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathbf{C}\right) \\\hline \text { 铬 } & \text { 银白色 } & 7.2 & 1857 & 2642 \\\hline \text { 钼 } & \text { 银色 } & 10.2 & 2610 & 4615 \\\hline \text { 钨 } & \text { 银色 } & 19.3 & 3410 & 5555 \\\hline\end{array}\end{aligned}$$
ⅦB族
$$\begin{aligned}&\text { VIIB族元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & \text { 颜色 } & \text { 密度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^3\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \multicolumn{1}{|c|}{\text { 点 }\left({ }^{\circ} \mathrm{C}\right)} \\\hline \text { 锰 } & \text { 银白色 } & 7.44 & 1246 & 2061 \\\hline \text { 锝 } & \text { 银色 } & 11.487 & 2172 & 4277 \\\hline \text { 铼 } & \text { 银色 } & 21.04 & 3180 & 5627 \\\hline\end{array}\end{aligned}$$
Ⅷ族
$$\begin{aligned}&\text { VIII族元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & {\text { 颜色 }} & \text { 密度 }\left(\times 10^3 \mathbf{k g} / \mathrm{m}^3\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathrm{C}\right) \\\hline \text { 铁 } & \text { 银白色 } & 7.86 & 1535 & 2861 \\\hline \text { 钴 } & \text { 银灰色 } & 8.9 & 1495 & 2527 \\\hline \text { 铂 } & \text { 银白色 } & 8.9 & 1453 & 2913 \\\hline \text { 钉 } & \text { 银白色 } & 12.3 & 2310 & 4150 \\\hline \text { 铑 } & \text { 银色 } & 12.41 & 1966 & 3695 \\\hline \text { 钯 } & \text { 银色 } & 12.02 & 1552 & 2963 \\\hline \text { 锇 } & \text { 银灰色 } & 22.48 & 3027 & \\\hline \text { 铱 } & \text { 银白色 } & 22.421 & 2443 & 5012 \\\hline \text { 铂 } & \text { 银白色 } & 21.45 & 1772 & 4428 \\\hline\end{array}\end{aligned}$$
ⅠB族
$$\begin{aligned}&\text { IB族元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline & \text { 元素单质 } & \text { 颜色 } & \text { 密度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^3\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathrm{C}\right) \\\hline \text { 铜 } & \text { 紫红色 } & 8.92 & 1084.6 & 2562 \\\hline \text { 银 } & \text { 银白色 } & 10.5 & 961 & 2162 \\\hline \text { 金 } & \text { 金黄色 } & 19.3 & 1046.68 & \\\hline\end{array}\end{aligned}$$
ⅡB族
$$\begin{aligned}&\text { IIB族元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & {\text { 颜色 }} & \text { 密度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^3\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathrm{C}\right) \\\hline \text { 锌 } & \text { 银白色 } & 7.14 & 419.6 & 907 \\\hline \text { 镉 } & \text { 银灰色 } & 8.65 & 320.9 & 765 \\\hline \text { 汖 } & \text { 银白色 } & 13.59 & -38.87 & 356.6 \\\hline\end{array}\end{aligned}$$
ⅢA族(硼族)
$$\begin{aligned}&\text { IIIA族(硼族)元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & \text { 颜色 } & \text { 密度 }\left(\times \mathbf{1 0} \mathbf{k g} / \mathrm{m}^{\mathbf{3}}\right) & \text { 熔点 }\left({ }^{\circ} \mathbf{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathbf{C}\right) \\\hline \text { 硼 } & \text { 黑色 } & 2.34 & 2076 & 3927 \\\hline \text { 铝 } & \text { 银白色 } & 2.7 & 660 & 2327 \\\hline \text { 镓 } & \text { 银白色 } & 5.904 & 29.76 & 2403 \\\hline \text { 铟 } & \text { 银白色 } & 7.31 & 156.2 & 2080 \\\hline \text { 铊 } & \text { 银白色 } & 11.85 & 308.5 & 1457 \\\hline\end{array}\end{aligned}$$
ⅣA族(碳族)
$$\begin{aligned}&\text { IVA族 (碳族) 元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & {\text { 颜色 }} & \text { 密度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^{\mathbf{3}}\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \\\hline \text { 沸点 }\left({ }^{\circ} \mathrm{C}\right) \\\hline \text { 碳 } & \text { 黑色 (石墨、炭黑等) } \\\text { 或无色 }(\text { 金刚石) } & & 3550 & 4827 \\\hline \text { 硅 } & \text { 黑色 } & 2.267 & 1414 & 2900 \\\hline \text { 锗 } & \text { 银白色 } & 2.33 & 938.25 & 2833 \\\hline \text { 锡 } & \text { 银白色 } & 5.35 & 231.89 & 2260 \\\hline \text { 铅 } & \text { 银白色 } & 7.28 & 327.502 & 1749 \\\hline\end{array}\end{aligned}$$
ⅥA族(氧族)
$$\begin{aligned}&\text { VIA族 (氧族) 元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & {\text { 颜色 }} & \text { 度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^3\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathbf{C}\right) \\\hline \text { 氧 } & \text { 无色 } & 0.00143 & -217.65 & -182.95 \\\hline \text { 硫 } & \text { 淡黄色 } & 2.07 & 115.36 & 444.6 \\\hline \text { 硒 } & \text { 红色 }(\text { 红硒 }) & 4.81 & 221 & 685 \\\hline \text { 碲 } & \text { 银白色 } & 8.24 & 449.65 & 988 \\\hline \text { 钋 } & \text { 银白色 } & 9.4 & 254 & 962 \\\hline\end{array}\end{aligned}$$
ⅦA族(卤素)
$$\begin{aligned}&\text { VIIA (卤素) 元素物理性质 }\\&\begin{array}{|l|l|l|l|l|l|}\hline {\text { 元素单质 }} & {\text { 颜色 }} & \text { 密度 }\left(\times 10^3 \mathrm{~kg} / \mathrm{m}^3\right) & \text { 熔点 }\left({ }^{\circ} \mathrm{C}\right) & \text { 沸点 }\left({ }^{\circ} \mathbf{C}\right) \\\hline \text { 氟 } & \text { 浅黄绿色 } & 0.0017 & -219.52 & -188.12 \\\hline \text { 氯 } & \text { 绿 } & 0.00321 & -100.84 & -34.04 \\\hline \text { 溴 } & \text { 棕红色 } & 3.119 & -7.1 & 58.8 \\\hline \text { 碘 } & \text { 紫黑色 } & 4.93 & 113.5 & 184.3 \\\hline \text { 砹 } & \text { 黑色 } & 10 & 302 & 370 \\\hline\end{array}\end{aligned}$$
O族(稀有气体)
氦 氖 氩 氪 氙 氡
1、由于稀有气体有在通电时发出彩光的特性,所以可以将其制成霓虹灯。
放射性元素
锝 钷 钋 砹 氡 钫 镭 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎
注:①放射性元素硬度多数不详;
②锎之后的元素各项性质均不详;
③铋放射性太弱,不归入最后一表。
原子半径
(1)除第1周期外,其他周期元素(稀有气体元素除外)的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大。(五、六周期间的副族除外)
元素化合价
(1)除第1周期外,同周期从左到右,第二周期元素最高正价由碱金属+1递增到氮元素+5(氟无正价,氧无最高正价),其他周期元素最高正价由碱金属+1递增到+7,非金属元素负价都由碳族-4递增到-1。
(2)同一主族的元素的最高正价、最低负价均相同。(O、F、18族除外)
单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(副族熔点在VIB族达到最高,以后依次递减)
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。(副族不规则)
元素的金属性
(1)同一周期的元素从左到右金属性递减,非金属性递增;
(2)同一主族元素从上到下金属性递增,非金属性递减。
最高价氧化物的水化物酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。(F和O除外)
非金属气态
元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
单质的氧化性
一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其单原子阴离子的还原性越弱。
元素位置推断
1、元素周期数等于核外电子层数;
2、主族元素的序数等于最外层电子数;
3、确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。在第一至第五周期时最后的差数小于等于10时差数就是族序数,差为8、9、10时为Ⅷ族,差数大于10时,则再减去10,最后结果为族序数;在第六、七周期时差数为1:ⅠA族,差数为2:ⅡA族,差数为3~17:镧系或锕系,差数介于18和21之间:减14,差数为22~24:Ⅷ族,差数大于25:减24,为对应的主族;
根据各周期所含的元素种类推断,用原子序数减去各周期所含的元素种数,当结果为“0”时,为零族;当为正数时,为周期表中从左向右数的纵行,如为“2”则为周期表中从左向右数的第二纵行,即第ⅡA族;当为负数时其主族序数为8+结果。所以应熟记各周期元素的种数,即2、8、8、18、18、32、32。如:
①114号元素在周期表中的位置114-2-8-8-18-18-32-32=-4,8+(-4)=4,即为第七周期,第ⅣA族。
②75号元素在周期表中的位置75-2-8-8-18-18=21,21-14=7,即为第六周期,第ⅦB族。
稀有气体元素
稀有气体也称为惰性气体,它们的化学性质很稳定,不易和其他物质发生化学反应。稳定的稀有气体为: 氦 ( $\mathrm{He})$ 、氙 $(\mathrm{Ne})$ 、氩 $(A r)$ 、氪 $(K r)$ 、芫 $(X e)$ 、氡 $(R n)$ 、气奥 $(O g$ ,为新元素,原字无法打出) 。
牢记稀有气体元素的原子序数:2、10、18、36、54、86、118,通过稀有气体的位置,为某已知原子序数的元素定位。
如:要推知 33 号元素的位置,因它在18和36之间,所以必在第4周期,由 36 号往左数,应在 $V A$ 族。
次级周期性
元素周期表中,从上到下p区元素的变化规律不是一条严格递增的曲线,而是一条锯齿状曲线。曲线上有两个拐点:第二周期和第四周期。按照相对论效应的计算,第六周期会出现第三个拐点。
第二周期的不规则性
成因是第二周期的内层电子少 (只有 $1 \mathrm{~s}^2$ ) ,原子半径特别小,所以第二周期元素成键的方式及种类和后面几个周期差异很 大。例如氮族元素 (VA),第3 6周期的五氯化物均已制得,但是 $\mathrm{NF}_5$ 却不存在,更不必说 $\mathrm{NCl}_5$ 等分子了。又如碳和硅的最大配 位数不同,导致了二氧化碳和二氧化硅晶体结构的不同。
第四周期的不规则性
第四周期的p区元素刚刚经过 $d$ 区,所以原子半径比同族的第三周期相比变化不大。因此,第四周期元素很多化合物较不稳 定,如HCIO 和 $\mathrm{HIO}_4$ 很早就被制得了,但 $\mathrm{HBrO}_4$ 却是在1967年才制得,且氧化性为高卤酸 (高氟酸除外,因热力学不稳定) 中最 强。
第六周期的不规则性
第六周期元素原子半径太大,6s电子电子云间隔很大,不易成键。除TI(III) 较稳定以外,其余第六周期p区元素均很难显 现族价。比如 $\mathrm{Bi}_2 \mathrm{O}_3$ 还原性比 $\mathrm{Sb}_2 \mathrm{O}_3$ 差得多, $\mathrm{Bi}_2 \mathrm{O}_5$ 氧化性比 $\mathrm{Sb}_2 \mathrm{O}_3$ 强得多,而Po (VI) 和At (VI) 预计不会存在。
1
一价氢氟钾钠银 二价氧钡钙镁锌
三铝四硅五价磷 二四六硫二四碳
一二铜汞二三铁一五七氯要记清
2
正一铜氢钾钠银 正二铜镁钙钡锌
三铝四硅四六硫 二四五氮三五磷
一五七氯二三铁 二四六七锰为正
碳有正四与正二 再把负价牢记心
负一溴碘与氟氯 负二氧硫三氮磷
3
正一氢银和钾钠 正二钙镁钡锌汞和铜
铝正三 硅正四 亚铁正二铁正三
氯在最后负一价 氧硫最后负二价
莫忘单质价为零
4
氢正一 氧负二
一价钾钠银 二价钡镁锌钙
三价铝 铁可变价
铜汞二价最常见
5
钾钠氢银正一 二钙钡镁锌
铝正三氧负二 氯常见负一
硫负二正四六 铁有正二三
一二铜二四碳 单质永归零
6
钾钠银氢+1价,氟氯溴碘-1价;
钙镁钡锌+2价,通常氧是-2价
二三铁,二四碳,三铝四硅五价磷;
一三五七正价氯,二四六硫锰四七;
铜汞二价最常见,单质化合价为零。
7
一价氯氢钾钠银,二价氧钙钡镁锌,三铝四硅五价磷;
二三铁,二四碳,二四六硫要记全;
铜汞二价最常见,单值为零永不变。
8
一价氯氢钾钠银,二价氧钙钡镁锌,
三铝四硅五氮磷,铜一二,铁二三;
原子团也要记清,氢氧负一铵正一,
酸根所有价为负,一硝二硫碳三磷
1
钾钠铵盐硝酸盐,
完全溶解不困难。
酸类溶解除硅酸,
溶碱钾钠钡和氨。
盐酸溶解除银盐,
硫酸难溶是钡铅。
碳酸磷酸钾钠铵,
碳酸氢盐都溶完。
注:此口诀只包括中学范围内的内容,比如四苯硼钾、高氯酸钾、氯铂酸钾、氯铂酸铵、氯铂酸铷、氯铂酸铯、高氯酸钾、氟硅酸钾、氟锆酸钾、氟钛酸钾、酒石酸氢钾、亚硝酸钴钾、酒石酸钠、高氯酸钠、三钛酸钠、铋酸钠微溶或不溶,碳酸氢钠浓度高是沉淀(侯氏制碱法),碳酸铍,铍酸钾可溶。
2
钾钠铵盐均可溶;硝盐入水影无踪
硫酸盐中钡不溶;氯化盐中银不溶;
碳酸盐中只溶钾、钠、铵。
碱只溶钾钠钙钡铵
3
钾钠硝铵溶,
盐酸除银汞。
碳酸磷酸盐,
能溶钾钠铵。
再说硫酸盐,
不溶有钡铅。
最后说碱类,
能溶钾钠钡。